CHIA SẺ, Tin cập nhật, Tin tức cập nhật
Tháng 8, Bộ Y tế sẽ xem xét cấp phép khẩn cấp vắc xin Nanocovax
Bộ Y tế đề nghị Công ty Nanogen trước ngày 15/8 gửi báo cáo dữ liệu nghiên cứu pha 2 và bước đầu pha 3, để từ đó Hội đồng đạo đức và Hội đồng cấp phép của Bộ xem xét cấp phép khẩn cấp.
Ngày 2/8, GS.TS Trần Văn Thuấn, Thứ trưởng Bộ Y tế chủ trì cuộc họp trực tuyến về rà soát tiến độ, thúc đẩy quá trình thử nghiệm lâm sàng, đôn đốc báo cáo kết quả nghiên cứu giai đoạn 1, 2, 3 (a,b) của vắc xin Nanocovax do Công ty cổ phần Công nghệ sinh học dược Nanogen sản xuất.
Công ty đang triển khai theo đề cương nghiên cứu. Cụ thể, pha 3 được thử nghiệm trên 13.000 người, chia làm 2 giai đoạn nhỏ (3a: 1.000 người và 3b: 12.000 người).
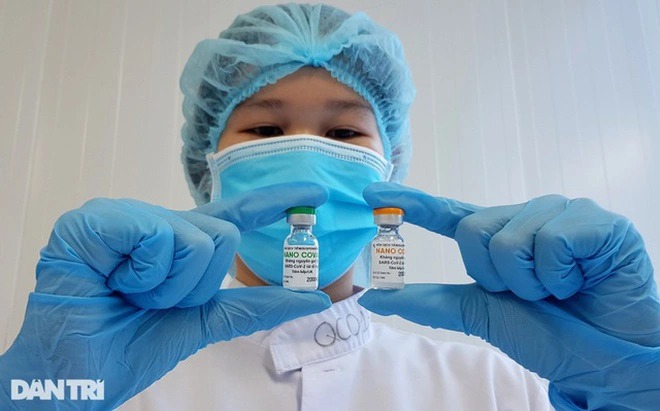
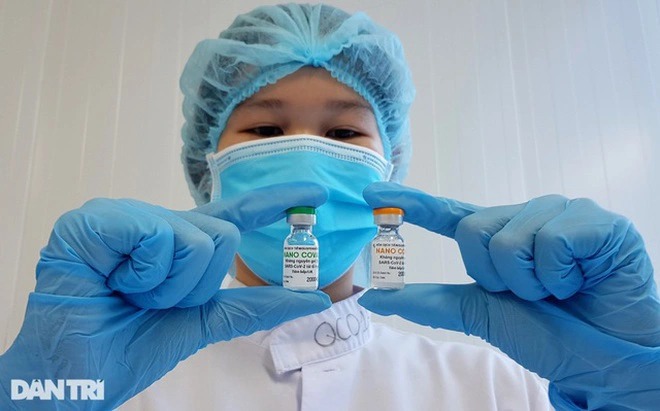
Kết quả D42 của 1.000 người pha 3a được thu thập cho thấy 100% đối tượng được tiêm Nanocovax có kháng thể trung hòa Surrogate trên ngưỡng 30%. 99,2% đối tượng chuyển đổi huyết thanh của kháng thể IgG kháng Protein S gấp 4 lần so với nền. Công ty tiếp tục theo dõi 1.000 đối tượng giai đoạn 3a và 12.000 đối tượng pha 3b theo đề cương nghiên cứu.
Nanocovax: Vắc xin an toàn và có tính sinh miễn dịch tương đối cao
Song song với việc xin cấp phép sử dụng khẩn cấp có điều kiện, Công ty Nanogen cũng kiến nghị Bộ Y tế, Hội đồng Đạo đức trong Nghiên cứu Y sinh học Quốc gia xem xét việc triển khai nghiên cứu giai đoạn 3c (tiêm cho khoảng 500.000 – 1.000.000 người). Đồng thời, nghiên cứu trên trẻ em từ 12 đến 18 tuổi, sau khi được cấp phép.
Sau khi nghe báo cáo kết luận của các chuyên gia đầu ngành, GS Trần Văn Thuấn khẳng định, Bộ Y tế rất mong sớm có vắc xin tự sản xuất trong nước để bảo vệ người dân, để giảm sự lệ thuộc về vắc xin nhập khẩu.
“Có tín hiệu mừng, vui là vắc xin an toàn và có tính sinh miễn dịch tương đối cao. Tuy nhiên, chúng ta chưa có dữ liệu chắc chắn về hiệu quả bảo vệ của vắc xin đến đâu. Chúng ta cần chờ thêm thời gian và kết quả nghiên cứu”, GS Thuấn nói.
Bộ Y tế luôn ủng hộ, mong muốn và tạo điều kiện thuận lợi nhất cho các công ty, cá nhân tham gia vào quá trình sản xuất vắc xin phòng chống Covid-19. Vì vậy, Bộ đã huy động nhiều nhà khoa học đầu ngành của đất nước tham gia vào đánh giá, nghiên cứu và thẩm định.
Bộ Y tế đề nghị Công ty Nanogen trước ngày 15/8, phải gửi báo cáo dữ liệu nghiên cứu pha 2 và bước đầu pha 3, từ đó Bộ Y tế có số liệu gửi Hội đồng đạo đức và Hội đồng cấp phép của Bộ Y tế xem xét cấp phép trong tình trạng khẩn cấp.